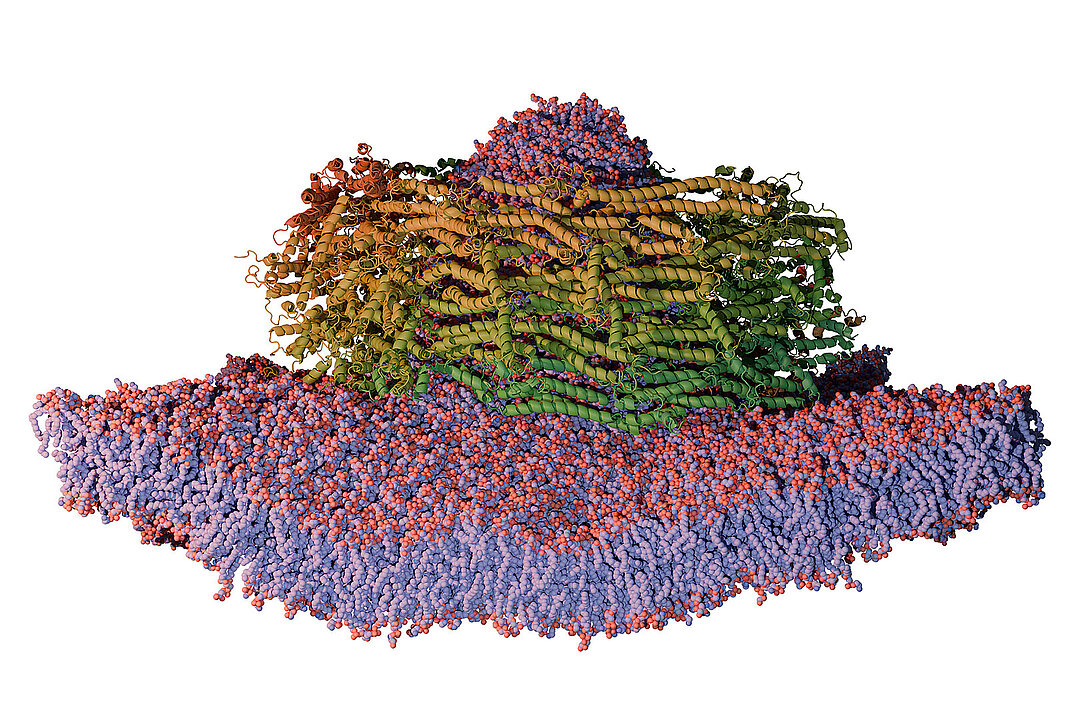
PspA gehört zu einer uralten Familie von Proteinen – der ESCRT-III-Superfamilie –, die in allen Domänen des Lebens Membranen in Form bringt. So schützen Prokaryoten wie Bakterien PspA die innere Membran bei Stress. Frühere Arbeiten des Teams hatten bereits Struktur und Verwandtschaft von PspA im Vergleich zu seinen eukaryotischen Gegenstücken (zu denen auch menschliche Zellen gehören) aufgezeigt und seine Rolle als Reparaturhelfer beschrieben. Mit der neuen Studie kommt nun ein entscheidendes Puzzlestück hinzu.
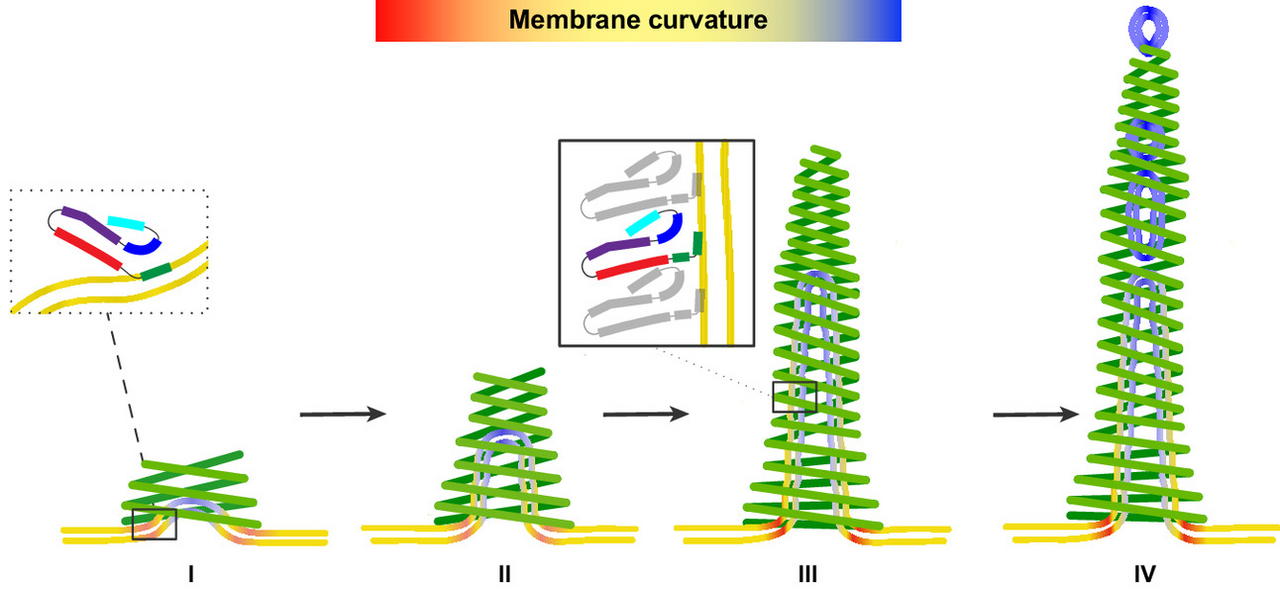
Mithilfe von Kryo-Elektronenmikroskopie und Molekulardynamik-Simulationen zeigten die Forschenden, wie PspA röhrenförmige Proteinkomplexe bildet, in deren Innerem die Zellmembran gebogen, verengt und schließlich in kleine Bläschen, sogenannte Vesikel, umgewandelt wird.
„Im Zentrum des Prozesses steht eine winzige Helixstruktur, die sich gezielt in die Membranoberfläche einbettet und sie verformt“, erklärt Esther Hudina vom Ernst Ruska-Centrum für Mikroskopie und Spektroskopie mit Elektronen (ER-C-3) des FZJ, eine der Erstautorinnen der Studie. Die Kryo-Elektronenmikroskopie am Ernst-Ruska Centrum lieferte dabei statische Schnappschüsse der Moleküle in Lösung.
„Auf diese Weise kann PspA beschädigte Membranabschnitte einschließen, formen und abschnüren, was vermutlich der Reparatur dient.“, erläutert der Bioinformatiker Dr. Stephan Schott-Verdugo vom Institut für Bio- und Geowissenschaften (IBG-4). Molekulardynamik-Simulationen auf dem Jülicher Superrechner JUWELS, durchgeführt am IBG-4 unter Leitung von Prof. Dr. Holger Gohlke, der zugleich eine Arbeitsgruppe am Institut für Pharmazeutische und Medizinische Chemie Professor der HHU leitet, machten die Bewegungen der Moleküle am Computer sichtbar. Sie lieferten zudem ein Modell, wie die für die Membrankrümmung notwendige Energie durch die fortschreitenden Helix-Membran-Interaktionen aufgebracht werden kann.
„Dass dieser Vorgang ganz ohne externe Energiezufuhr auskommt, hat uns überrascht“, betont Prof. Dr. Carsten Sachse, Letztautor, Leiter des Ernst Ruska-Centrum für Mikroskopie und Spektroskopie mit Elektronen für Strukturbiologie (ER-C-3) sowie Professor am Department Biologie der HHU. „Die Energie stammt allein aus der Bindung des Proteins an die Membran – ein bemerkenswerter biologischer Trick.“
Die Studie liefert nicht nur neue Grundlagen für die Zellbiologie, sondern eröffnet auch Perspektiven für biotechnologische Anwendungen, etwa beim gezielten Transport von Wirkstoffen in künstlichen Vesikeln.
Originalpublikation
Esther Hudina , Stephan Schott-Verdugo, Benedikt Junglas, Mirka Kutzner , Ilona Ritter , Nadja Hellmann, Dirk Schneider, Holger Gohlke, Carsten Sachse. The bacterial ESCRT-III PspA rods thin lipid tubules and increasemembrane curvature through helix α0 interactions. PNAS (2025)